
FDA 在 2024 年授予 ADC 創紀錄數量的審查指定

在 2024 年,FDA 授予抗體藥物偶聯物(ADCs)創紀錄的 63 個審評認定,幾乎是 2023 年 35 個的兩倍。這一增長突顯了 FDA 在推進 ADC 技術用於癌症治療方面的承諾,反映了監管政策向支持這些精準治療的轉變。Enhertu 獲得了最多的認定,表明其在 ADC 領域的顯著影響
抗體藥物偶聯物(ADCs)近年來獲得了顯著的發展勢頭,得益於其在癌症治療中的臨牀成功。自 2019 年以來,FDA 通過每年增加審評指定數量,越來越鼓勵和加速 ADCs 的開發。這個趨勢在 2024 年達到了新高,FDA 向 ADCs 授予了創紀錄的 63 個指定,幾乎是 2023 年 35 個的兩倍。
ADCs 利用連接子將單克隆抗體的特異性與細胞毒性藥物的效力結合起來,使其能夠選擇性地靶向並消滅癌細胞。這種高度選擇性的抗體導向癌細胞殺傷顯著改善了傳統癌症治療方法(如化療)的效果。
在 2009 年至 2018 年期間,授予 ADCs 的年度審評指定數量穩步增加,複合年增長率(CAGR)為 22%。在此期間,對 ADCs 的信心逐漸增強,因為這一技術背後的科學和製造過程得到了完善和驗證。儘管 2019 年審評指定活動有所下降,但隨後的五年時間(2019 至 2024 年)代表了一個密集活動的時代,審評指定授予數量以 73.3% 的 CAGR 增長。2024 年,FDA 授予了創紀錄的 63 個指定,幾乎是 2023 年 35 個的兩倍(圖 1)。這一顯著增長突顯了 FDA 促進這些精準療法市場準入的意圖日益增強。
圖 1:FDA 授予 ADCs 的年度審評指定數量(2009-2014)
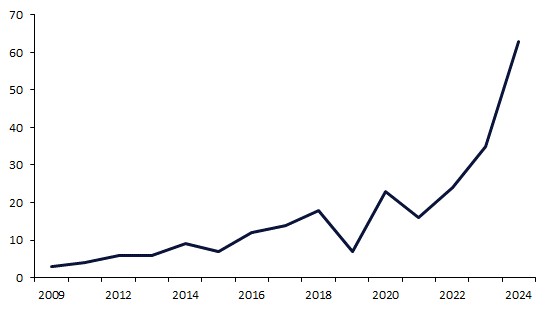
來源:GlobalData,藥物數據庫(訪問日期:2025 年 9 月 24 日)© GlobalData。注意:單一藥物可以獲得多個審評指定。
2019 年是 ADCs 的一個里程碑年份,三款產品獲得了 FDA 批准:大冢製藥的 trastuzumab deruxtecan(Enhertu)、Astellas 的 enfortumab vedotin(Padcev)和 Genentech 的 polatuzumab vedotin(Polivy)。這是單一年份中獲得的 ADCs 批准數量最多的一次。這個歷史性的 ADCs 年份,隨後審評指定活動的激增,表明監管機構在推動癌症 ADCs 產品方面的明確轉變。
在 2024 年,63 個審評指定授予了 35 個獨立的 ADCs。相比之下,在 2019 年,僅有七個指定授予了六種藥物。這一指定數量的九倍增長,以及藥物數量的六倍增長,表明越來越多的公司進入 ADCs 領域,且 FDA 正在積極支持它們的開發過程。
在所有 ADCs 中,Enhertu 共獲得了 FDA 最多的審評指定,達到 34 個。這是 Takeda 的 Adcetris(排名第二)總數的 2.5 倍以上。Enhertu 的 92% 的審評指定是在該產品首次獲得 FDA 批准後授予的,反映出其早期臨牀成功促使 FDA 加速其對其他癌症類型的批准。

GlobalData 戰略情報
不要讓政策變化讓你措手不及。通過實時數據和專家分析保持主動。
由 GlobalData 提供
ADCs 的靶向方法的精確性使其能夠提供更有效的癌症治療。自 2019 年 ADCs 批准的創紀錄年份以來,FDA 持續增加審評指定數量,強調了監管機構在推進這一技術和更快將這些靶向療法帶給患者方面的承諾。


