
FDA 在 2024 年授予 ADC 创纪录数量的审查指定

在 2024 年,FDA 授予抗体药物偶联物(ADCs)创纪录的 63 个审评认定,几乎是 2023 年 35 个的两倍。这一增长突显了 FDA 在推进 ADC 技术用于癌症治疗方面的承诺,反映了监管政策向支持这些精准治疗的转变。Enhertu 获得了最多的认定,表明其在 ADC 领域的显著影响
抗体药物偶联物(ADCs)近年来获得了显著的发展势头,得益于其在癌症治疗中的临床成功。自 2019 年以来,FDA 通过每年增加审评指定数量,越来越鼓励和加速 ADCs 的开发。这个趋势在 2024 年达到了新高,FDA 向 ADCs 授予了创纪录的 63 个指定,几乎是 2023 年 35 个的两倍。
ADCs 利用连接子将单克隆抗体的特异性与细胞毒性药物的效力结合起来,使其能够选择性地靶向并消灭癌细胞。这种高度选择性的抗体导向癌细胞杀伤显著改善了传统癌症治疗方法(如化疗)的效果。
在 2009 年至 2018 年期间,授予 ADCs 的年度审评指定数量稳步增加,复合年增长率(CAGR)为 22%。在此期间,对 ADCs 的信心逐渐增强,因为这一技术背后的科学和制造过程得到了完善和验证。尽管 2019 年审评指定活动有所下降,但随后的五年时间(2019 至 2024 年)代表了一个密集活动的时代,审评指定授予数量以 73.3% 的 CAGR 增长。2024 年,FDA 授予了创纪录的 63 个指定,几乎是 2023 年 35 个的两倍(图 1)。这一显著增长突显了 FDA 促进这些精准疗法市场准入的意图日益增强。
图 1:FDA 授予 ADCs 的年度审评指定数量(2009-2014)
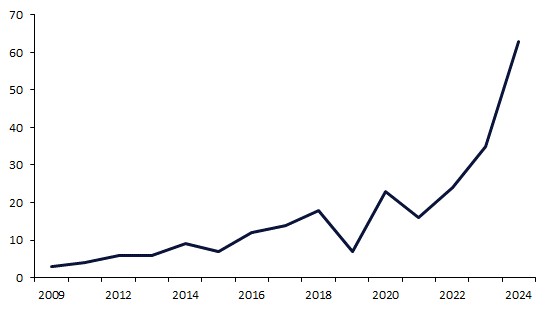
来源:GlobalData,药物数据库(访问日期:2025 年 9 月 24 日)© GlobalData。注意:单一药物可以获得多个审评指定。
2019 年是 ADCs 的一个里程碑年份,三款产品获得了 FDA 批准:大冢制药的 trastuzumab deruxtecan(Enhertu)、Astellas 的 enfortumab vedotin(Padcev)和 Genentech 的 polatuzumab vedotin(Polivy)。这是单一年份中获得的 ADCs 批准数量最多的一次。这个历史性的 ADCs 年份,随后审评指定活动的激增,表明监管机构在推动癌症 ADCs 产品方面的明确转变。
在 2024 年,63 个审评指定授予了 35 个独立的 ADCs。相比之下,在 2019 年,仅有七个指定授予了六种药物。这一指定数量的九倍增长,以及药物数量的六倍增长,表明越来越多的公司进入 ADCs 领域,且 FDA 正在积极支持它们的开发过程。
在所有 ADCs 中,Enhertu 共获得了 FDA 最多的审评指定,达到 34 个。这是 Takeda 的 Adcetris(排名第二)总数的 2.5 倍以上。Enhertu 的 92% 的审评指定是在该产品首次获得 FDA 批准后授予的,反映出其早期临床成功促使 FDA 加速其对其他癌症类型的批准。

GlobalData 战略情报
不要让政策变化让你措手不及。通过实时数据和专家分析保持主动。
由 GlobalData 提供
ADCs 的靶向方法的精确性使其能够提供更有效的癌症治疗。自 2019 年 ADCs 批准的创纪录年份以来,FDA 持续增加审评指定数量,强调了监管机构在推进这一技术和更快将这些靶向疗法带给患者方面的承诺。


